
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



具有更強免疫原性的mRNA疫苗你了解多少?(下)
本文文章來源于知乎《mRNA疫苗學習(下)》作者:卷毛哥的奇跡
此前AVT小編給小伙伴們分享了一下具有更強免疫原性的mRNA疫苗的相關知識,mRNA疫苗需要你了解的知識可不只有那些哦,本期我們接著聊一聊mRNA疫苗的那些事!
裸露的mRNA作為一種外源的核酸物質,進入體內后很容易免疫系統識別和被核酸酶降解,因此直接用裸露的mRNA作為疫苗其藥理作用會大打折扣。為了提高mRNA疫苗的免疫效率,通常需要特殊遞送系統的輔助。
mRNA疫苗的給藥方式
mRNA疫苗的給藥方式非常重要,會決定mRNA疫苗在體內的代謝,及目的抗原蛋白翻譯的效率。例如,如果直接靜脈注射未經任何處理的裸露mRNA,就會被血液中的核酸酶迅速降解。
mRNA疫苗的給藥也分為系統給藥或者局部給藥,根據抗原蛋白需要表達的位置來決定。如果是預防性疫苗,為了引起較強的免疫反應,通常用皮下和肌肉注射的局部給藥。如果是治療性mRNA疫苗通常通過腹腔或者靜脈注射系統給藥(這也包括下文述及的經DC細胞給藥)。

mRNA疫苗局部和系統給藥
經DC細胞給藥
mRNA疫苗另外一種非常重要的給藥方式是通過DC細胞的轉染進行給藥,分為體內和體外兩種DC細胞介導的方式。DC細胞是人體重要的抗原遞呈細胞,其攝取抗原后可以誘導隨后的免疫反應。在體外分離得到人體未成熟的DC細胞后,可以通過電穿孔技術轉染mRNA,再把轉染后的DC細胞過繼入人體,產生被動免疫。但是通過體外DC轉染的方式遞送mRNA疫苗對技術的要求非常高,需要較長的體外培養時間,而且首先需要獲取人體的DC細胞,在普通條件下難以實現。另外一個通過DC細胞給藥的方式是淋巴內給藥,mRNA被直接注射到淋巴內,這樣mRNA就可以被淋巴內固有DC細胞獲取,但是這種給藥方式通常需要手術輔助,導致給藥非常復雜且帶了大量的風險。
因此,經DC細胞給藥的方式不適合預防性mRNA疫苗的給藥,只有在一些治療性mRNA疫苗的給藥可能會被使用。
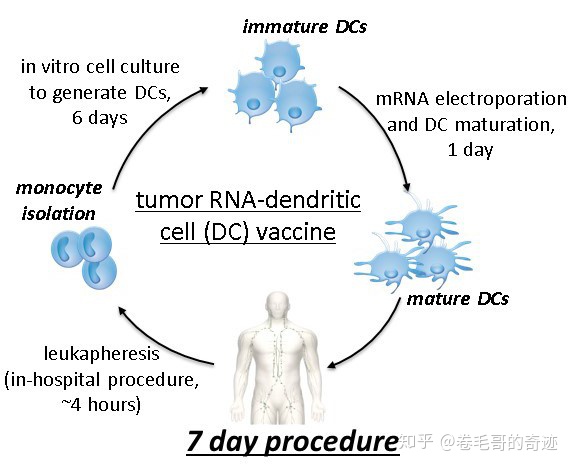
mRNA經體外DC系統給藥(癌癥疫苗)
mRNA的制劑系統
為了保證mRNA疫苗的代謝穩定性和免疫活性,除了慎重評估給藥方式外,還需要對mRNA疫苗的劑型進行特殊設計。mRNA進入體內后,首先面臨周圍組中(如:血液)核酸酶的降解,另外還需要穿過具有磷脂雙分子層細胞膜。因此,mRNA疫苗的制劑系統需要保護mRNA不被核酸酶降解,而且還需要促進mRNA被細胞(APC、B細胞和T細胞等免疫細胞)攝取。
已經有大量的mRNA制劑系統見諸報道,其中的很多已經進入臨床試驗階段。這些制劑技術都是通過形成特殊的mRNA載體,來實現mRNA疫苗的遞送,這些載體技術包括:魚精蛋白載體技術、納米顆粒脂質體載體技術、多聚體載體技術
·魚精蛋白載體:
魚精蛋白是一種天然的陽離子蛋白,可以把帶負電的mRNA分子絡合成納米級別的核酸顆粒,從而保護mRNA不被血清中的RNA酶降解;但是由于魚精蛋白和mRNA的結合太緊密,因此采用這種制劑的mRNA疫苗的蛋白表達效率會受限,另外抗原的表達很大程度上也受到魚精蛋白和mRNA比例的影響。德國CureVac公司開發的 RNActive平臺成功解決了這個問題,通過RNActive平臺得到的魚精蛋白-mRNA復合物其中,魚精蛋白作為TLR7/8拮抗劑可以誘發Th1細胞反應,mRNA可以表達目的蛋白誘導特異的免疫反應。
另外,魚精蛋白-mRNA組成的納米級顆粒還可以進一步制備成脂質體,這種脂質體-魚精蛋白-mRNA的制劑形式,兼有脂質體載體和魚精蛋白載體的優勢。
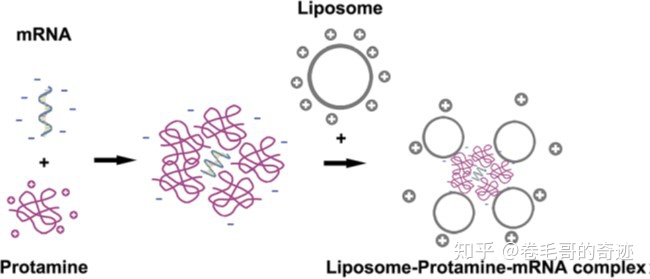
魚精蛋白制劑及魚精蛋白-脂質體制劑示意圖
·納米顆粒脂質體(Lipid nanoparticles,LNPs):
LNP由四部分組成:陽離子脂質體、脂質體相連的聚乙二醇(增加半衰期),膽固醇(起到穩定制劑結構的作用)和磷脂(支持形成磷脂雙分子層)。脂質體實際上是一種人工膜,可以將藥物包封于類脂質雙分子層內而形成微型泡囊體。
LNP遞送RNA的原理目前還不完全清楚,但是通常認為,LNP通過非共價親和力和細胞膜結合并通過內吞作用被攝取,進入細胞后mRNA逃離內吞小泡,被釋放到細胞質中表達靶蛋白。有意思的是,LNP還可以通過相反的胞吐作用被排出細胞外,這也是通過LNP進行mRNA給藥需要注意的點。mRNA–LNP復合物的那器官為肝臟,進入體內后制劑和載脂蛋白E結合,隨后通過受體介導的內吞作用,被肝臟細胞攝取;
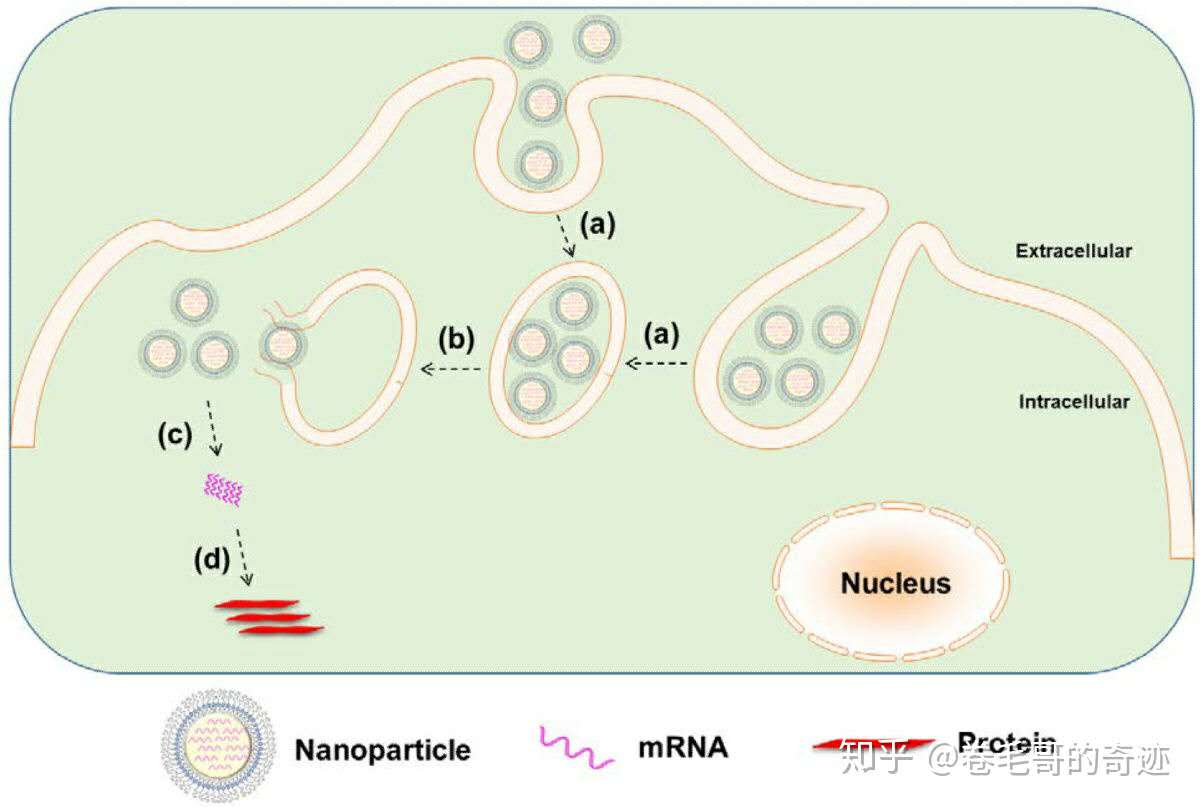
細胞內部脂質體mRNA疫苗的蛋白表
·多聚體載體
多聚體載體技術在臨床上的應用并沒有脂質體類載體廣,但是作為核酸藥物的載體也表現了優異特性。多聚體載體通常為陽離子聚合物,陽離子聚合物可以通過靜電作用跟帶負電的mRNA形成多聚體,最終形成polyplexes或者micelleplexes;micelleplex由陽離子兩親性的共聚物生成,可以聚合形成膠束,通常表現出比polyplex更優異的穩定性,因為后者并不會形成膠束結構。在進行多聚體載體設計的時候需要額外考慮多聚體載體的分子量以及帶電荷量,過大的載體分子和過多的載電量通常導致載體和mRNA分子結合太過穩定,而導致mRNA的表達效率過低。
在眾多多聚物載體材料中,聚乙烯亞胺(PEI)是最常用的陽離子聚合物,已經被廣用作mRNA疫苗的載體;大分子量的聚乙烯亞胺更適合作為自我復制性mRNA疫苗的載體,因為自我復制性mRNA的分子量較且結構復雜,但是高分子量的聚乙烯亞胺同時會帶來較高的毒性副作用,而且高分子量的聚乙烯亞胺對mRNA的結合非常穩定以至于無法順利的在細胞質中釋放mRNA;但是小分子量的PEI的轉染能力有限;除了PEI外還有其他的分子被用來作為載體,例如:甲基丙烯酸二甲氨基乙酯(PDMAEMA)。
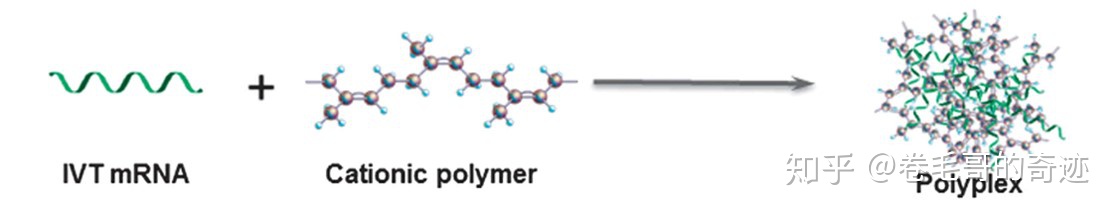
多聚體生成路線
·脂質體-多聚體納米顆粒載體
脂質體-多聚體納米顆粒載體,顧名思義為脂質體載體技術和多聚體納米顆粒技術的聯合使用。在結構上,多聚體材料是載體的內核,而脂質或脂質-PEG包裹著內核形成脂質體。
mRNA可以通過兩種形式跟脂質體-多聚體納米顆粒載體結合,第一種方式是結合在帶正電荷的多聚體核心中,第二種方式是吸附在帶正電荷的多聚體核心外側。采用第二種方式結合的mRNA,可能更容易被釋放。
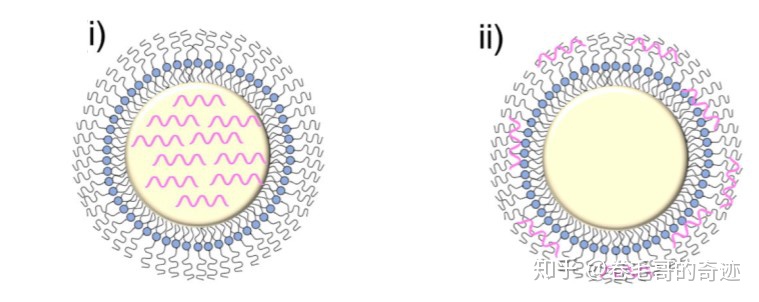
左:第一種方式;右:第二種方式
參考文獻
1.Biomaterials for mRNA delivery[J]. Biomater. Sci. 2015, 3(12):10.1039.C5BM00198F.
2.Men K , Zhang R , Zhang X , et al. Delivery of modified mRNA encoding vesicular stomatitis virus matrix protein for colon cancer gene therapy[J]. Rsc Advances, 2018, 8(22):12104-12115.
3.Sahin U , Karikó, Katalin, Türeci, ?zlem. mRNA-based therapeutics — developing a new class of drugs[J]. Nature Reviews Drug Discovery, 2014, 13(10):759-780.
4.Kowalski P S , Rudra A , Miao L , et al. Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery[J]. Molecular Therapy, 2019.
5.Lu T , Xun S . Recent advances in mRNA vaccine delivery[J]. Nano Research, 2018.
6.Pardi N , Hogan M J , Porter F W , et al. mRNA vaccines — a new era in vaccinology[J]. Nature Reviews Drug Discovery, 2018.
7.Youn H , Chung J K . Modified mRNA as an alternative to plasmid DNA (pDNA) for transcript replacement and vaccination therapy[J]. Expert Opinion on Biological Therapy, 2015:1-12.
8.Schlake T , Thess A , Fotin-Mleczek M , et al. Developing mRNA-vaccine technologies[J]. RNA biology, 2012, 9(11):1319-1330.



 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




